臨床試驗合同
收藏價格: ¥5 .99 ¥599
篇幅: 19 頁
36,569人
收藏
7,314人
下載
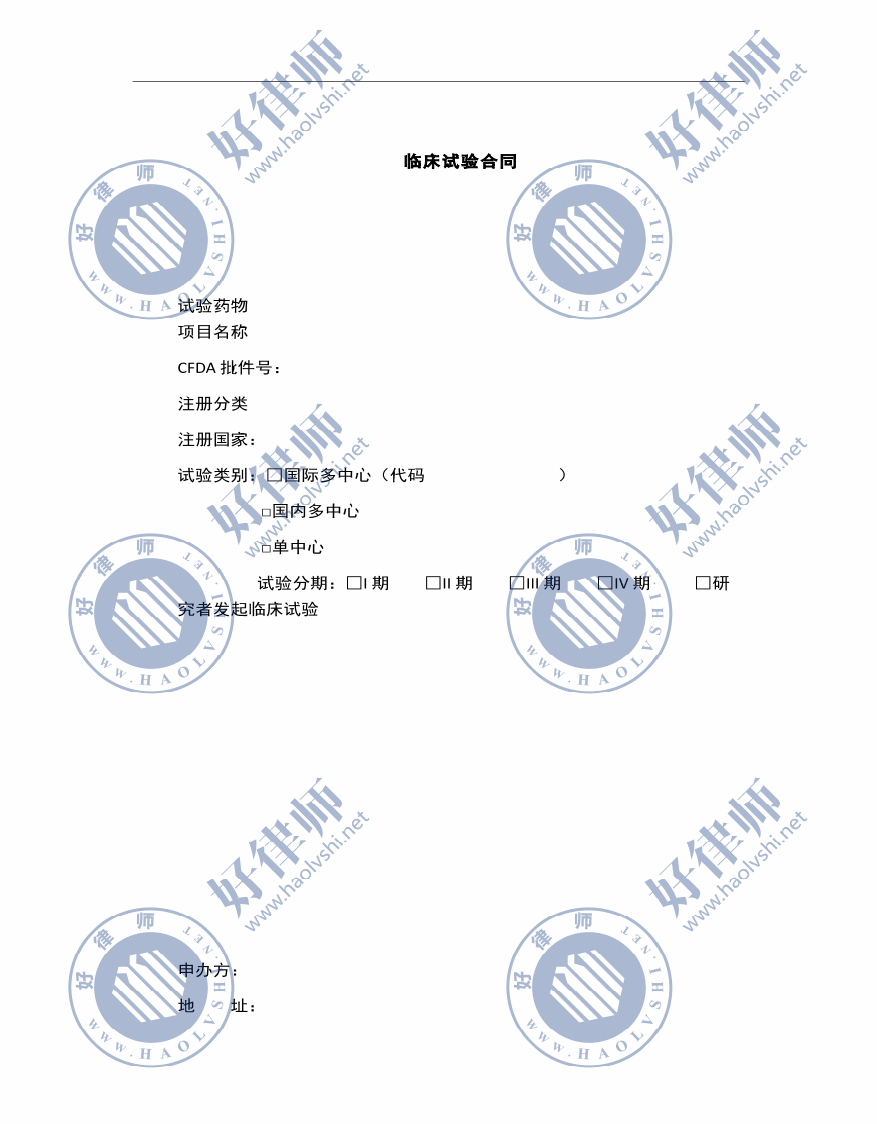
臨床試驗合同
試驗藥物 項目名稱
CFDA 批件號:
注冊分類
注冊國家:
試驗類別:□國際多中心(代碼 )
□國內(nèi)多中心
□單中心
試驗分期:□I 期 □II 期 □III 期 □IV 期 □研究者發(fā)起臨床試驗
申辦方:
地 址:
法定代表人:
郵政編碼:
項目負(fù)責(zé)人:
聯(lián)系電話(固定工作電話和手機(jī)):
傳真:
E-mail:
CRO: 地 址:
法人:
郵政編碼:
項目負(fù)責(zé)人:
聯(lián)系電話(固定工作電話和手機(jī)):
傳真:
E-mail:
研究機(jī)構(gòu):
地址:
機(jī)構(gòu)負(fù)責(zé)人:
郵政編碼:
聯(lián)系電話:
傳真:
E-mail:
主要研究者:
專業(yè)組:
聯(lián)系電話:
傳真:
E-mail:
委 托 方(甲方):
申辦方:××××××××公司 和(或)CRO:_ ×××××××公司_
受托方(乙方):××××××××××××××××醫(yī)院
委托方將依據(jù)名為“ ”的方案【方案編號: 】 開展一項臨床試驗,,從而對申辦方______________________研制的__________試驗藥物/藥品進(jìn)行臨床試驗,,并且受托方在閱讀了研究方案、臨床研究者手冊以及與試驗用藥物有關(guān)的足夠信息以評 價其參與該研究的興趣后,,研究機(jī)構(gòu)和研究者同意參與研究,,并保證有足夠的權(quán)限、能力和經(jīng)驗進(jìn)行臨床試驗,,并擁有必備的基礎(chǔ)設(shè)施和技術(shù)手段保證試驗的順利進(jìn)行,,依據(jù)《中華人民共和國合同 法》、《藥物臨床試驗質(zhì)量管理規(guī)范》以及該臨床試驗方案的規(guī)定,,合同雙方在平等互利,、充分表達(dá)各自意愿的基礎(chǔ)上,就以下各條所涉及的相關(guān)技術(shù)和法律問題,,經(jīng)協(xié)商一致達(dá)成如下協(xié)議,,由簽約雙方共同恪守。自雙方簽訂合同之日起即生效,,任何一方不得單獨終止合同,。
1 雙方合作的主體、合作方式,、目的和內(nèi)容:
1 合同主體
本合同的主體是甲方:________________和乙方:__________ 醫(yī)院,。
2 根據(jù)國家食品藥品監(jiān)督管理總局第( )號批件,甲方委托乙方對甲方研制的 ×××× (注冊分類:××××)進(jìn)行 期試驗,以評價其 ,。
3 試驗名稱為:
4 乙方負(fù)責(zé)項目的專業(yè)組為:____________,,主要研究者為__________。
該試驗總設(shè)計例數(shù)為_____例,,甲方計劃委托乙方完成 例,,具體研究內(nèi)容詳見附件 1: 經(jīng)倫理委員會審核通過的臨床試驗方案(版本號:__________,版本日期________)及修正案(版
本號________,,版本日期__________),。
5
2 合同各方承擔(dān)的責(zé)任:
甲方(____________________)根據(jù)《藥物臨床試驗質(zhì)量管理規(guī)范》中對申辦方、監(jiān)查員的職責(zé)限定,,甲方應(yīng)在合同中明確如下職責(zé):
1 提供試驗相關(guān)的文件,、藥物、設(shè)備,、耗材及研究經(jīng)費等,;對試驗用藥物進(jìn)行適當(dāng)?shù)陌b與標(biāo)簽,并符合臨床試驗的設(shè)計需要,。
2 為臨床試驗質(zhì)量保證責(zé)任方,,應(yīng)派遣合格的監(jiān)查員,必要時可組織獨立的稽查,,對試驗的質(zhì)量進(jìn)行監(jiān)查,,確保所有試驗資料符合相關(guān)要求,監(jiān)查頻率應(yīng)和入組進(jìn)度相協(xié)調(diào),。甲方應(yīng)及時向乙方告知可能影響受試者健康或安全的嚴(yán)重或持續(xù)違背方案事件和重要信息,。
3 負(fù)責(zé)與乙方一起對主要研究者及其研究團(tuán)隊進(jìn)行資格審核,以選擇合格的研究者,。
4 負(fù)責(zé)對乙方的研究人員進(jìn)行該臨床研究有關(guān)的培訓(xùn),。
5 應(yīng)及時向乙方 PI 告知試驗中存在問題,,以便乙方采取相關(guān)措施改進(jìn)/保護(hù)受試者,。
6 在決定中止或暫停臨床試驗前,須書面通知研究機(jī)構(gòu),、研究者和倫理委員會,,并述明理由。
7 乙方同意試驗終止后,,相關(guān)資料歸檔按照乙方的要求進(jìn)行,。
8 本試驗一旦發(fā)生需要及時處理(包括但不限于治療、賠償?shù)龋┎涣际录驀?yán)重不良事件,,若需要甲方協(xié)調(diào),,甲方監(jiān)查員或者負(fù)責(zé)人必須在盡快到達(dá)乙方機(jī)構(gòu),協(xié)助處理嚴(yán)重不良事件后果并采取必要的措施,以保證受試者的安全和權(quán)益,,并及時向藥品監(jiān)督管理部門和衛(wèi)生行政管理部門報告,,同時向涉及同一藥物的臨床試驗的其他研究單位通報不良事件。
9 向倫理委員會和研究機(jī)構(gòu)遞交最終的臨床試驗分中心小結(jié)或總結(jié)報告,。
10 發(fā)生與試驗相關(guān)的損害或死亡時,,由申辦方承擔(dān)參加臨床試驗受試者的醫(yī)療費用及相應(yīng)的經(jīng)濟(jì)補償或者賠償。
11 未經(jīng)受試者書面同意,,受試者的個人信息/標(biāo)本等不能擅自用于商業(yè)用途及探索性研究,。
12 如涉及 CRO 公司的合同,還應(yīng)增加以下要點:
13 提供申辦方委托 CRO 承擔(dān)臨床試驗相關(guān)業(yè)務(wù)的《委托函》,,明確說明 CRO 受申辦方委托承擔(dān)和不承擔(dān)的責(zé)任與義務(wù)范疇,。

溫馨提示: 該文書為.doc格式,推薦您使用word軟件打開。文檔字體及段落格式參見預(yù)覽效果,下載后不會帶有“好律師”水印,方便您的使用,。
大家正在問
更多>平臺推薦律師
 更多>
更多>
1,、積極回復(fù)文字問律師且質(zhì)量較好;
2,、提供訂單服務(wù)的數(shù)量及質(zhì)量較高,;
3、積極向“業(yè)界觀點”板塊投稿,;
4,、服務(wù)方黃頁各項信息全面、完善,。
熱門服務(wù)

























